纖維母性網狀細胞為肺癌中的T細胞塑造碉堡?
Quick look
腫瘤內部的免疫微環境基本上都存在高度異質性,從免疫細胞密集分布到完全缺乏等等。目前的證據顯示,腫瘤抗原特異性T細胞(Tumor-specific T cell)若要順利的啟動及維持他們的活性,仰賴腫瘤引流淋巴結(tumor draining lymph node)和腫瘤組織內的微環境,特別是三級淋巴結構(tertiary lymphoid structure,TLS),其通常位於腫瘤邊緣並由B細胞主導。而TLS中的B細胞活性也與Immune checkpoint inhibitor的成功率息息相關。
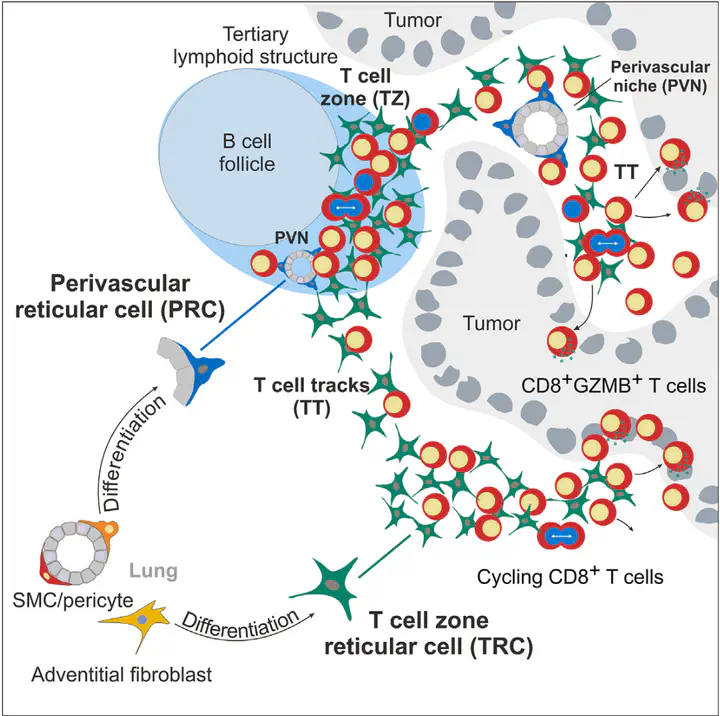
這些免疫細胞由專門的纖維母細胞(如T細胞區網狀細胞和血管周圍網狀細胞)支撐,而這之間的交互作用也從TLS透過某種物理架構延伸到腫瘤內部。本篇研究通過單細胞轉錄組學和高解析度顯微技術,發現了在肺癌中形成特定T細胞環境的纖維母細胞亞群(fibroblastic reticular cell)。這些FRC與免疫細胞的互動促進了TLS的形成、T細胞軌跡中的分化,以及控制T細胞活性。實驗顯示,破壞腫瘤微環境中FRC與免疫細胞的互動會降低CD8+ T細胞的抗腫瘤活性並促進腫瘤生長。
由此可見,特定的FRC亞群通過提供增長和分化的信號,在腫瘤內部支持保護性免疫反應(protective immunity),對抗腫瘤生長。
FRC細胞與肺癌腫瘤內部T細胞關係不尋常?
對肺癌來說,有肋膜侵犯是一項不好的預後因子,而研究也發現,由subpleural region(Subpleural margin, SM,有肋膜侵犯的部分)切下的腫瘤,與位於central(central margin, CM,同一塊腫瘤,靠近中心的部分)的腫瘤在免疫細胞的組成上有顯著個差異。SM腫瘤的淋巴細胞比較鬆散,而且主要位於腫瘤周圍,但CM腫瘤內部有明顯的T細胞浸潤(圖一)。團隊也發現CM腫瘤T細胞附近充滿ACTA2陽性的纖維母細胞,而這些細胞與SM相比,與吸引T細胞有關的chemokine基因CCL19與CCL21之表現亮顯著較高。
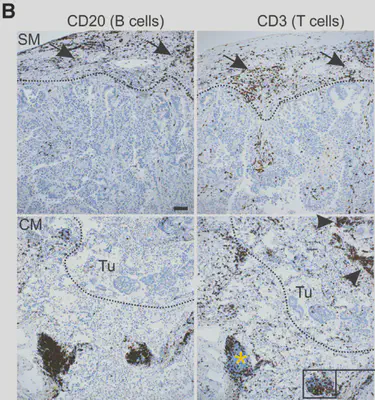
近一步用高解析顯微鏡發現,腫瘤內的T細胞棲息區(niche),與腫瘤TLS有連結,而CCL19+ FRC更是與T細胞有接觸,而FRC表現的CCL19量的多寡也形成了一條T細胞依循的梯度(gradient),由此可見CCL19+ FRC似乎主導了腫瘤內T細胞的遷移。
探索其中的分子機制
精細的交互作用
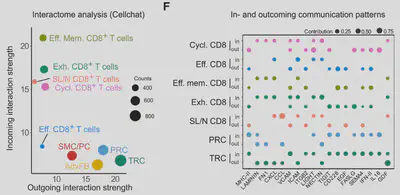
團隊使用螢光顯微鏡擷取圖片並重組成3D影像,發現在TLS中的CCL19+ POSTN+ PDPN+ 的FRC與T細胞有緊密的接觸,同樣的情形也在CM中血管附近的FRC出現。而利用scRNA-seq分析免疫細胞的interactome也發現,腫瘤內的PRC(perivascular reticular cell)與TRC(T cell zone reticular cell)主要跟CD8+ T細胞作用(圖二)。團隊利用CellChat分析CCL19+FRC與CD8+T細胞之間的通訊涉及以下信號:
- 遷移信號:CXCL12和CXCL16。
- 細胞間的黏附:VCAM1。
- 激活因子:包括type II interferon。
- 微環境因子:如LTBR、TNFRSF14和NOTCH3,為CD8+T細胞創造適合的微環境。
總結來說,CCL19+TRCs和PRCs與CD8+T細胞的互動通過一系列信號網絡調節,形成特定的纖維母性微環境,進一步支持T細胞的功能活化和發育。
FRC分化路徑
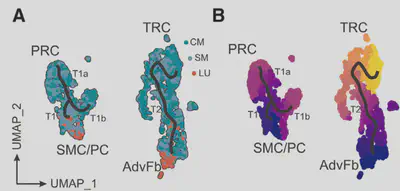
團隊發現除了cancer-associated fibroblast(CAF)會表達CCL19之外,正常肺組織的mural細胞與adventitia細胞也會表現CCL19。因此作者合理懷疑表現CCL19的PRC與TRC來自於血管周圍的纖維母細胞。團隊使用分化路徑分析(differentiation trajectory analysis)後也證實mural細胞會衍生成為PRC;而adventitia細胞會於TRC路徑的根部(圖三)。而團隊進一步使用小鼠肺癌模型(Lewis lung carcinoma expressing the viral glycoprotein peptide 33 of the lymphocytic choriomeningitis virus)也支持這項發現。
小鼠模型也能出現TLS?
根據先前的研究,藉由病毒激活的CD8+T細胞會在發炎組織中形成TLS,因此團隊在小鼠植入肺腫瘤細胞後在第15天接受疫苗注射,此疫苗設計為重組冠狀病毒的質體,可以表現LCMV glycoprotein gp33與myeloid cell stimulating factor Flt3l。在施打疫苗後,腫瘤成功出現腫瘤邊緣與腫瘤內部的TLS,而在小鼠的腫瘤內部的FRC也與CD8+T細胞緊密接觸。
FRC對CD8+T細胞抗腫瘤的影響?
研究顯示,腫瘤微環境中的FRC在促進抗腫瘤 CD8+ T細胞免疫中發揮關鍵作用。通過使用白喉毒素(DT)去除小鼠Ccl19-Cre+ 細胞,發現FRC的缺失導致腫瘤失去FRC的網絡,顯著減少腫瘤內CD8+ T細胞的募集,並加速腫瘤生長。同時,腫瘤特異性CD8+ T細胞的效應功能(如 IFN-γ、TNF 和 granzyme B 的產生)以及增殖活性(KI67 表達)均顯著下降,且表現出更高的耗竭標誌(如 PD1、TIM3、KLRG1)。FRC 通過粘附分子(如 ICAM1、VCAM1)、趨化因子(CXCL16)和免疫調節細胞因子(如 TGF-β1、TSLP)與CD8+ T 細胞進行交互,促進其細胞毒性、增殖和分化。總結來說,FRC在腫瘤微環境中透過多重免疫調控途徑增強了抗腫瘤免疫反應,其缺失會削弱T細胞功能並促進腫瘤進展。
結論
這篇研究揭示,腫瘤微環境中的CCL19表達FRCs在促進抗腫瘤CD8+ T細胞免疫反應中扮演關鍵角色。這些FRCs(包括PRCs和TRCs)形成三維細胞網絡,作為T細胞進入腫瘤實質的“通道”,同時支持T細胞在腫瘤淋巴結(TDLNs)和腫瘤相關淋巴樣結構(TLS)中的活化與擴增。CCL19+ FRCs還維持腫瘤特異性CD8+T細胞的增殖和效應分化,其功能受腫瘤和基質細胞產生的信號調控。這些FRC網絡不僅促進T細胞的遷移,還與患者的良好預後密切相關,未來應致力於探討其他腫瘤類型中FRC的發育途徑,並設計促進PRC/TRC分化的策略,以增強抗腫瘤免疫反應。