黑色素瘤如何對免疫治療產生抗藥性?

Quick look
這篇文章研究了Immune checkpoint inhibitor(ICI)療法在黑色素瘤中(melanoma)的抗藥性機制。通過分析來自患者的短期腫瘤細胞系(short term cell line))和匹配的腫瘤樣本,作者發現了三種不同的抗藥性機制,分別涉及抗原表達的喪失、抗原呈現的破壞,以及與PTEN缺失相關的免疫細胞排斥。這些抗藥性機制揭示了可能的救援性治療策略,例如恢復MHC的表達、促進先天免疫反應、以及重新刺激抗原的呈現。
簡介
免疫檢查點抑制劑(ICI)針對PD-1的療法已徹底改變了轉移性黑色素瘤患者的治療方式。在許多III期臨床試驗中(如CheckMate-067和KEYNOTE-006),PD-1抑制劑顯示了42-45%的客觀反應率,以及6.5年42%的總體存活率。然而,約有55%的黑色素瘤患者對單獨的PD-1抑制劑療法存在先天性抗藥性,並且幾乎25%的患者在治療初期有反應,但在兩年內產生了抗藥性。因此,抗藥性問題仍然是ICI療法的一個重大挑戰。本研究通過全面分析黑色素瘤中對ICI的抗藥性機制,試圖探索這些ICI治療失敗的因素。
為此,研究人員針對18名接受PD-1 抑制劑並且病程仍然持續進展的第四期黑色素瘤患者(9名PD-1抑制劑;9名PD-1抑制劑+CTLA4 抑制劑)進行切片,建立了22株短期腫瘤細胞系和匹配的腫瘤樣本,通過基因組、轉錄組和流式細胞儀的分析方法,探討抗藥性的產生機制。他們總結出了三個主要的抗藥性機制:抗原表達的喪失、抗原呈現的破壞和免疫細胞排斥,這些機制或許可能為治療提供新的想法。
研究結果
抗原表達消失了?
因為約有4-10%對PD-1抑制劑有抗藥性的黑色素瘤具有IFNγ(干擾素γ)功能的喪失,因此研究團隊以IFNγ的刺激來當切入點,結果發現,在22株細胞係接受IFNγ(1000 U/ml IFNγ,24小時)後,只有一株細胞(SCC16-0016)沒有反應,究其原因發現此細胞株之JAK2及INSL6基因有出現缺失或是融合的現象,AK2的缺失影響到MHC-I和MHC-II分子的表達,這是因為JAK2在IFNγ信號中負責STAT1(信號轉導和轉錄活化因子1)的磷酸化,進而促使MHC的表達。JAK2缺失導致了STAT1無法被磷酸化,而這樣的缺陷導致這株細胞在接受IFNγ後無法正常表現MHC-I、MHC-II、PD-L1、PD-L2,也沒有出現細胞增殖趨緩的特徵,表示這條路徑影響到了此細胞株該有的免疫反應。而在短暫植入wild-type JAK2後,SCC16-0016得以順利在IFNγ刺激後表達MHC-I。
而在剩下的21株細胞中,有6株細胞具有內源性IFNγ表現,而這種內源性的IFNγ是也被發現與黑色素瘤去分化(de-differentiated)有關(MITF與SOX10表現下降以及melanoma-specific antigen, Melan-A的喪失)(圖 1)。這種去分化的過程使腫瘤細胞喪失了wild-type抗原的表達能力,從而減少了腫瘤細胞的免疫原性(immunogenicty),也削弱了腫瘤對免疫系統的可見性(visibility)。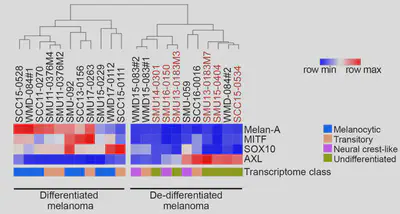
內源性IFNγ造就免疫抑制的腫瘤微環境?
雖然具有內源性IFNγ的細胞株也會表達較高與其調控相關的基因如IRF1/9、LGALS9與MHC-I,然而在細胞激素(cytokine/chemokine)分析時發現,這些細胞因為處於去分化的狀態,分泌的細胞激素與那些處於分化態的細胞在接受IFNγ刺激後不同,說明了不同細胞狀態在誘導免疫反應的複雜性。
這些具有內源性IFNγ的細胞會對腫瘤微環境造成什麼影響呢?團隊接著利用多參數流式細胞分析發現,與此類細胞株配對之腫瘤具有較少的CD45+細胞含量與相對較高的巨噬細胞數量,同時也發現這類腫瘤有較少的活性CD8+ T細胞。
另外針對SCC16-0016細胞株的配對腫瘤(JAK2 mutaant)分析後也發現,跟其他細胞株的配對腫瘤相比,SCC16-0016細胞株的配對腫瘤具有最高的NK細胞比例,這個發現也驗證了NK細胞會在第一防線時針對MHC-I陰性的癌細胞做攻擊的現象,也就是所謂的missing self recognistion。
抗原呈現遭到抑制?
因為這些去分化的腫瘤內表現抗原的程度較低,導致腫瘤內含有較少的活性CD8+ T細胞(透過分析表面標誌來確定如PD1++Tbet+),為了證實這個現象並非只是同步發現的結果,團隊針對兩株去分化細胞株加載了HLA-A02載體後,以melan-A peptide來刺激,結果發現在共同培養的環境下,可以誘導CD8+ T細胞的活化(IFNγ+CD107+)(圖二),表示植入的wild-type抗原有辦法增加免疫細胞的抗腫瘤能力。然而即便是植入抗原,仍然無法逆轉細胞型態成分化狀態。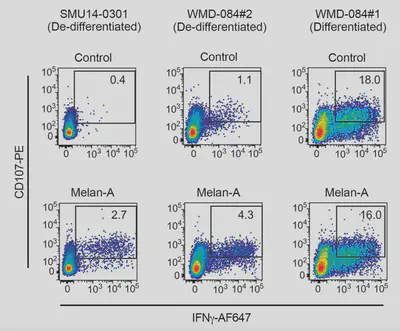
複雜的機制,讓抗原的表現消失?
除了抗原表達的喪失外,研究還發現了一系列影響抗原呈現的獨立機制,這些機制也會導致免疫檢查點抑制劑的抗藥性。其中一個重要的機制是B2M基因的功能喪失突變。團隊發現有兩株細胞具有B2M轉錄片段消失的現象,並且利用全轉錄組(whole transcriptome)及全外顯組(whole exome)分析確認了exon 1 deletion及frameshift mutation。B2M是MHC-I複合體的重要組成部分(圖三),當B2M基因出現突變時,MHC-I的組裝和細胞表面表達均會受到影響,從而降低腫瘤細胞被T細胞識別的可能性。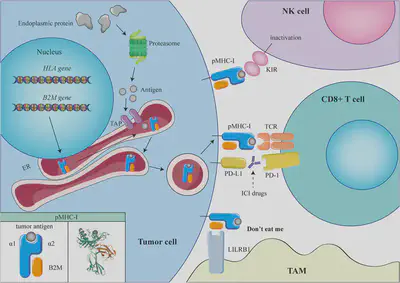
此外,CIITA(MHC-II轉錄調控因子)基因的表達沉默也是一個關鍵因素。CIITA是控制MHC-II表達的核心轉錄因子,在具有B2M基因變異的細胞株中,若該基因被表觀遺傳機制(如DNA甲基化或組蛋白去乙醯化)抑制時,MHC-II的表達將顯著降低,進而影響抗原呈現。研究中通過表觀遺傳抑制劑(如HDAC抑制劑)恢復CIITA的表達,結果顯示MHC-II的表達可以部分恢復,這表明表觀遺傳調控在抗原呈遞中的重要性。這些結果告訴我們,造成黑色素瘤抗原消失的原因不只有IFNγ訊息路徑的問題,也有其他複雜的因素共同作用。
免疫細胞排斥?
PTEN基因的缺失與腫瘤中的免疫細胞排斥有著密切的關聯。PTEN是一個腫瘤抑制基因,其缺失會導致腫瘤細胞分泌更多的免疫抑制性分子,如TGF-β等,從而阻礙免疫細胞(尤其是CD8+ T細胞)進入腫瘤微環境。在研究中,PTEN缺失的黑色素瘤顯示出更低的CD8+ T細胞浸潤,並且在腫瘤微環境中存在更高比例的巨噬細胞,這些巨噬細胞通常具有免疫抑制的功能,進一步降低了腫瘤對免疫治療的反應。
PTEN缺失的黑色素瘤還與腦轉移有關。研究發現,腦轉移腫瘤中PTEN缺失的比例較高,這些腫瘤不僅缺乏CD8+ T細胞的浸潤,還顯示出較高的調節性T細胞(Tregs)和suppressive myeloid細胞含量,這些免疫細胞的存在進一步加劇了腫瘤的免疫抑制狀態,使ICI療法難以奏效。
探討
本研究結果顯示,黑色素瘤對免疫檢查點抑制劑的抗藥性主要涉及三大方面:抗原表達的喪失、抗原呈現的破壞以及免疫細胞排斥。抗原表達喪失與腫瘤細胞的去分化和內源性的IFNγ訊號有關,這些機制共同降低了腫瘤細胞的免疫抗原性,並使其難以被T細胞識別。抗原呈現的破壞則主要涉及MHC-I和MHC-II的異常,這些異常通常由基因突變或表觀遺傳調控引起。而PTEN的缺失則通過影響腫瘤微環境,抑制了免疫細胞的浸潤和活性,進一步促進了腫瘤的免疫逃脫。
根據這些發現,研究者提出了一些潛在的治療救援策略。例如,對於抗原呈現異常的腫瘤,可以通過表觀遺傳調控劑(如HDAC抑制劑)恢復MHC表達,從而增強免疫系統對腫瘤的識別。此外,對於因PTEN缺失而造成免疫細胞排斥的腫瘤,可以考慮使用刺激先天免疫系統的療法,如Toll樣受體激動劑,來增強腫瘤微環境中的免疫活性。
去分化的黑色素瘤則更具挑戰性,因為這些腫瘤通常表現出較高的抗藥性和免疫逃脫能力。研究者建議,結合免疫療法與促進鐵依賴性氧化壓力的藥物(如鐵死亡誘導劑),可能有助於改善免疫檢查點抑制劑的療效,因為先前研究發現去分化的黑色素瘤對鐵死亡誘導劑具有一定的敏感度。此外,針對腫瘤微環境中的免疫抑制因素,如Tregs和免疫抑制性巨噬細胞,也應該考慮相應的干預措施,以減少這些細胞對抗腫瘤免疫反應的負面影響。
這項研究為理解黑色素瘤的免疫檢查點抑制劑抗藥性提供了重要的分子和功能線索,並為未來的治療策略提供了方向。通過精準識別不同的抗藥性機制,並針對性地進行治療,我們有望改善黑色素瘤患者的治療效果,特別是對於那些對現有免疫療法無反應的患者。這些新策略的探索與應用,將可能為免疫治療的救援治療開創新的局面。