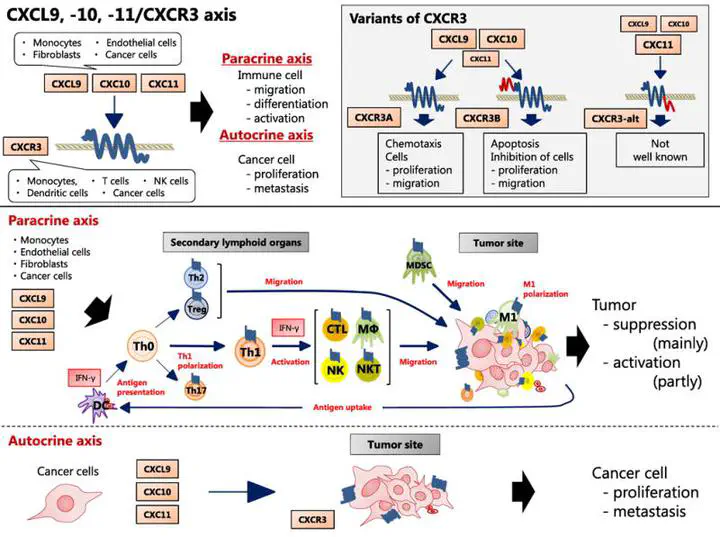
CXCL9/10/11–CXCR3 軸:免疫調控與腫瘤行為的雙面刃
Quick look
本篇參考2018年發表在Cancer Treatment Review 的文章,回顧了免疫反應中很重要的軸:CXCL9/10/11-CXCR3,了解這條軸的意義將能對癌症免疫治療有更深一層的理解。
CXCL9/10/11/CXCR3 axis
趨化激素(chemokines)是一群小分子蛋白質,分子量約為 8–15 kDa,主要功能是透過與G蛋白偶聯受體(G-protein coupled receptors)結合,誘導白血球的趨化(chemotaxis)、分化與血管通透性增加,進而促進白血球從血管移動至發炎或腫瘤部位。這些激素在免疫反應與腫瘤微環境中扮演極其重要的「指揮官」角色。
CXCL9、CXCL10、CXCL11 是CXC家族中不含ELR(Glu-Leu-Arg)序列的成員,其專一接受器為 CXCR3。這些chemokine 主要由單核球、纖維母細胞、內皮細胞與癌細胞分泌,分泌機制多受IFN-γ誘導,而TNF-α可進一步增強其上調。這些細胞類似「哨兵」,釋放的激素猶如「集合號」,吸引「將士」—免疫效應細胞進入戰場。
CXCR3 則主要表現在 Th1細胞、部分樹突細胞(DC)、NK 細胞、CD8+ T 細胞與癌細胞上。其表現也受 IFN-γ 誘導。此一表現型態顯示,CXCR3 軸線是免疫系統調動與活化的重要路徑。而癌細胞也可表現CXCR3,顯示其可能藉由模仿免疫細胞來逃避免疫監視,甚至促進自身轉移。
在未活化的 T 細胞(Th0)中,CXCR3 表現量低;然而當樹突細胞呈遞抗原(MHC-II)後,T 細胞活化並快速上調 CXCR3,趨向 Th1 分化,進而分泌 IFN-γ,活化 CTL、NK、NKT 細胞與巨噬細胞等免疫效應細胞,形成正回饋免疫循環。
從結構上看,CXCR3 屬於G蛋白偶聯受體,也稱為 CD183,具有兩個特異性的胞內結構區域:
- CXCL9/10靠其 C端胞內區域(carboxy-terminal domain)來活化。
- CXCL11 則主要靠第三胞內環結合(third intracellular loop)來活化。
此外,CXCR3具有三個主要變異型:
CXCR3A:經典型,促進細胞趨化與增生CXCR3B:誘導細胞凋亡、抑制遷移,並可與CXCL4結合(由活化血小板釋放)CXCR3-alt:主要媒介CXCL11的功能,但其結合與訊號傳導機制尚待釐清
這些趨化激素彼此在功能與表現調控上有所區別:
CXCL9(又稱 MIG, monokine induced by IFN-γ)
- 僅由 IFN-γ 強烈誘導,對 IFN-α/β 無明顯反應
- 位於染色體 4
- 主要介導淋巴球的局部浸潤與腫瘤抑制
- 動物實驗顯示,缺乏CXCL9的腫瘤細胞 (CXCL9-deficient) 有更高的致癌潛能 (tumorigenicity)
CXCL10(又稱 IP-10, interferon-γ-induced protein 10)
- 由 IFN-γ、IFN-α/β 誘導,TNF-α可弱誘導 –> 多重誘導潛能
- 可由 NF-κB 活化,在缺氧與發炎反應初期扮演關鍵角色
- 其他協同IFN-γ的誘導因子包括 IRF3、
TLR、RIG-I、MDA-5 等 - 有研究指出,CXCL10的血中濃度與頭頸癌放療後淋巴球數量有關(CXCL9 則無明顯關聯)
CXCL11(又稱 I-TAC, interferon-inducible T cell alpha chemoattractant)
- 由 IFN-γ、IFN-β 誘導,IFN-α可弱誘導
- 結合CXCR3親和力最高,且結合區域與CXCL9/10不同
- 可同時與
CXCR7結合 → 可能參與腫瘤浸潤與抑制細胞凋亡
由於 CXCL9/10/11 均為不含 ELR 序列的 CXC chemokines,因此在理論上它們會:
- 促進淋巴球遷徙
- 抑制血管新生→ 具有抗腫瘤潛力
然而,部分研究卻指出這些chemokines亦可能促進腫瘤轉移與增生,形成矛盾現象。這種差異可能來自CXCR3亞型的表現不同,例如:
- CXCR3A促進遷移與轉移
- CXCR3B則
抑制腫瘤生長並誘導凋亡
這突顯了CXCL9/10/11–CXCR3軸的「雙面性」:在免疫細胞中可促進免疫活化與腫瘤清除,而在腫瘤細胞中卻可能促進轉移與免疫逃脫。
個人假設:同一個接受器CXCR3會有不同的結合區,可能是演化過程中節省能量又可以達到多樣功能的方式。
CXCL9/10/11–CXCR3軸的總體功能
這個軸在免疫細胞的遷移、分化與活化中扮演關鍵角色。各種疾病中的免疫反應取決於浸潤到病灶部位的白血球類型。此軸也會直接作用於癌細胞,促進癌細胞的增殖與轉移。臨床上,CXCR3 表現量與癌症轉移潛能與預後有關。
免疫細胞的遷移
- CXCL9、CXCL10、CXCL11 對
Th1細胞、CTLs、NK細胞都有誘導遷移的效果。 - CXCR3 缺失小鼠模型證實,缺乏 CXCR3 的 CTLs 和 NK 細胞無法有效進入腫瘤區域,
腫瘤長得更快、生存率變差。 - CXCL9/10/11 還能吸引 Th1 細胞並抑制 Th2 細胞的遷移(透過拮抗 CCR3)。
γδT細胞的遷移也依賴 CXCL9–CXCR3。CXCL4/CXCR3B軸可引發凋亡,但不誘導 T 細胞遷移,可能有其他功能。
免疫細胞的分化
- CXCL9/10/11 一般促進 Th1 分化,但也有不同功能表現。
- CXCL10 可促進
T-bet、RORγ的表現,誘導 Tr1 (Foxp1- type 1 regulatory cells) 或 Th17 分化(透過 STAT1/4/5)。 - CXCL11 反而會降低 RORγ,傾向誘導 Tr1 或
Th2細胞(透過 mTOR 路徑)。 - CXCR3 軸也會影響腫瘤相關巨噬細胞(TAMs) 的極化:
- M1 → 抗腫瘤
- M2 → 促腫瘤
- 缺乏 CXCR3 會導致偏向 M2 極化、IL-4 增加,抗腫瘤免疫減弱。
- 有研究指出 CXCR3 陽性的 B 細胞會誘導 M2 極化(如肝癌中)。
免疫細胞的活化
CXCL9/10/11 可促進 Th1 活化,進而產生 IFN-γ、TNF-α、IL-2,加強對腫瘤的免疫攻擊。IFN-γ 可反過來促進 CXCL9/10/11 的釋放,形成正回饋循環。NK 細胞可透過 CXCR3 被活化,也能促進樹突細胞功能。
腫瘤中的 CXCR3 軸:雙面刃
- 旁分泌作用(paracrine): CXCL9/10/11 從免疫細胞釋放,誘導抗腫瘤免疫。
- 自分泌作用(autocrine): 癌細胞本身表現 CXCR3,CXCL9/10/11 反而促進 癌細胞增殖、血管新生、轉移。
- CXCR3-A 是主要促進癌轉移的亞型。
- CXCR3A 的選擇性抑制可能是治療轉移的策略。
預後與臨床意義
- 高 CXCR3 表現與癌症轉移、預後不良有關。
- 不同研究對於 CXCL9/10/11 表現與預後的關係有矛盾結果:
- 有研究顯示高 CXCL9、CXCL10 表現 → 預後差 / 治療反應不佳
- 也有研究顯示相反 → 高表現反而預後較佳
- 這可能與不同癌種、組織背景、炎症程度有關。
- Weisi 等人開發了一種「整體表達評分系統」,整合 CXCL9/10/11 表達來預測病人預後。
CXCL9, -10, -11/CXCR3軸作為癌症治療標的
這條免疫軸線具有雙向功能:
- 旁分泌功能(paracrine):來自免疫細胞的 CXCL9/10/11 可招募抗腫瘤細胞(如 Th1、CTL、NK、M1 巨噬細胞),發揮抗腫瘤作用。
- 自分泌功能(autocrine):
癌細胞自身產生並接受 CXCL9/10/11 刺激會促進癌細胞增生、轉移與血管新生。 假說:如果癌細胞本身有autocrine能力,訊息路徑會轉變為刺激增生,但如果來源是免疫細胞,則會抵抗腫瘤生長。
激活旁分泌軸的研究成果
利用 CXCL9/10/11 刺激免疫細胞進入腫瘤微環境(TME)以達到抗癌目的,已有多項動物實驗顯示效果良好:
- 結腸癌、肺癌:
Plasmid CXCL9 + Cisplatin->增加CTLs、抑制腫瘤生長 - 腎細胞癌:
局部CXCL9 + 系統性IL-2->抑制腫瘤與血管新生 - 肺癌:
CXCL10腫瘤內注射->提高小鼠存活率 - 黑色素瘤、肉瘤:
CXCL10基因轉導->抑制腫瘤生長 - 多發性骨髓瘤:
CXCL10-Ig融合蛋白->延長半衰期,誘導CTL與NK細胞浸潤 - 神經膠質瘤:
CXCL10-EGFRvIII 融合蛋白(IP10-scFv)+ CTL給藥->增加腫瘤浸潤淋巴細胞、生存期延長
關於CXCL11的治療爭議
CXCL11 除了可招募 CTL/NK,有時也會促進 Treg 或 Th2 細胞 的極化,產生免疫抑制效果。
在間皮瘤模型中,CXCL11 搭配腫瘤選擇性病毒載體可增強CTL與NK浸潤,延長生存。但在自體免疫腦脊髓炎模型中,CXCL11-Ig 融合蛋白促進 Treg 分化,快速緩解疾病。所以,CXCL11的作用依疾病背景而異,其治療用途需謹慎評估。
CXCR3 拮抗劑(抗-CXCR3)療法的利與弊
CXCR3 拮抗劑(例如 AMG487) 被用來阻止癌細胞自分泌的 CXCR3 活化,尤其是CXCR3A。
成果如下:
- 結腸癌、骨肉瘤: AMG487 抑制腫瘤生長與肺轉移
- 乳癌: 僅抑制肺轉移,不影響原位腫瘤生長
- 肝轉移: AMG487 無效
問題: AMG487
抑制所有CXCR3變異型(CXCR3A, B, alt),可能也抑制了免疫細胞的旁分泌抗腫瘤效果,導致反效果。
未來方向:雙管齊下的策略
建議的策略是:
- 同時促進免疫活化(提供 CXCL9/10)
- 並選擇性抑制癌細胞的 CXCR3A(避免全抑 CXCR3)
這樣的組合治療可能能夠:
- 增強免疫攻擊效果
- 減少轉移風險
- 避免削弱身體的免疫反應
CXCR3軸與免疫檢查點抑制劑(PD-1/PD-L1)的交互作用
- PD-1在腫瘤部位的T細胞表現明顯高於peripheral blood。
- 抗PD-1抗體可阻斷免疫逃逸、激活T細胞。
CXCL10 與 IFN-γ 表現會在 PD-1 抑制後上升(CXCL9 與 CXCL11 則不顯著)。- Chheda 等人指出,PD-1 單獨在 CXCR3-knockout 小鼠中無效 →
PD-1治療需依賴 CXCR3 路徑發揮作用。 5.CTLA-4 抑制劑(ipilimumab)也被證實可增加 CXCL9/10/11 表現,尤其在預後良好的病人。
DPP4 抑制劑提升 CXCL10 功效
- DPP4 酶會截斷 CXCL10 的N端,使其
喪失招募淋巴球功能。 - DPP4 抑制劑可保留活性 CXCL10,
提升 T 細胞進入腫瘤,增強免疫治療效力。 - DPP4 抑制劑為臨床可用藥物、副作用少,有望成為免疫療法輔助藥。
COX 抑制劑與 CXCL9/10 軸的正向調控
- COX-2 表現與 CXCL9 呈負相關(在乳癌中)。
抑制 COX(COX-1 / COX-2)→ 增加 CXCL9/10 表達,提升腫瘤浸潤淋巴球、改善預後。- COX-2 抑制劑 + PD-1 抗體(用海藻酸水凝膠載體):增加 Th1/CTL 數量、CXCL9/10 表達、降低 Tregs 與 MDSCs 抑制細胞。單獨使用 PD-1 抑制劑無法達到此效果
CXCR3軸也可增強以下療法的效力
- Lapatinib + Doxorubicin
- 全反式維甲酸(ATRA)
- 傳統化療藥物
CXCR3軸作為免疫療法的生物標記與作用平台
- CXCL9/10/11、CCL5 是轉移性黑色素瘤 T 細胞移植治療(adoptive T cell transfer)的潛在預測標記。
- MAGE-A3 疫苗治療中,CXCL9/10 表現與療效正相關(在黑色素瘤與非小細胞肺癌)
- 此軸與以下免疫療法皆有交集:
- 樹突細胞疫苗治療
- IL-2 治療
- IL-7 治療
表觀遺傳與miRNA調控
miR-21(癌基因miRNA) 被證實調控乳癌細胞中的 CCL5 與 CXCL10 表達。 因此,表觀遺傳因子也參與 CXCR3 軸的調控
結論
CXCL9/10/11–CXCR3 軸不僅是免疫細胞遷徙與活化的關鍵橋梁,也在腫瘤微環境中扮演著雙重角色。其在正常免疫反應中能促進 Th1 細胞極化、活化 CTLs 與 NK 細胞,形成強而有力的抗腫瘤攻擊。然而,當腫瘤細胞表現 CXCR3 並利用此軸線進行自分泌信號傳遞時,則可能反過來促進腫瘤增殖、血管新生與遠端轉移,突顯了這條軸線的「雙面刃」特性。
因此,對於 CXCR3 的不同變異型功能進行選擇性調控,將是未來精準腫瘤免疫治療的重要方向。同時,CXCR3 軸亦可作為免疫檢查點抑制劑(如 anti-PD-1)、DPP4 抑制劑、COX 抑制劑等新興療法的強化平台,具備高度整合潛力。
未來研究應著重於: 探討 CXCR3 不同變異型在各種腫瘤類型中的功能分化 發展同時促進免疫旁分泌、抑制腫瘤自分泌的雙效治療策略 評估 CXCL9/10/11 表現作為預後與療效反應的生物標記 綜合而言,CXCL9/10/11–CXCR3 軸不僅揭示了腫瘤與免疫系統之間的精密互動,也為發展新型免疫治療提供了關鍵的機會與方向。