計算生物學聊聊:藥物開發的現況與挑戰

Quick look
本篇介紹藥物開發的現況,筆記出自於美國麻省理工學院的計算生物學課程MLCB24。 課程影片請看這裡。
藥物的定義
從技術角度來說,藥物被定義為由藥典或藥物配方手冊所認可的物質。它必須符合嚴格的標準,包括其成分、製造過程及純度等方面的要求。詳細的定義包括:
- 用途:藥物旨在用於診斷、治療、緩解、治癒或預防疾病。這一用途將它與其他物質或化合物區分開來。
- 法規:藥物在法規上與食品和醫療器材分開進行管理。儘管存在像醫療食品這樣專為特定疾病的飲食需求而設計的特殊分類,但這些並未被歸類為藥物。此外,醫療器材雖然對醫療非常重要,但它們遵循獨立的法規。
藥物主要分為兩大類:
- 小分子藥物:這些是
化學合成的化合物,傳統上是製藥研究的重點,通常以口服或注射形式服用。 - 生物製劑:這些是由
活細胞或生物體生產的較大且更複雜的分子,包括抗體、疫苗和基因療法。生物製劑通常需要更複雜的製造過程及保存系統。
藥物在人類歷史中的角色
藥物的使用與發展深深植根於人類歷史,幾乎每個文化都探索過藥用物質。從歷史上看,早期的藥物發現通常來自於大自然,尤其是植物,並受到傳統知識的傳承。以下是一些常見起源於古代的藥物:
罌粟萃取物:歷史上用於止痛,罌粟萃取物促成了鴉片類藥物(例如嗎啡和可待因)的發現,這些藥物至今仍是疼痛管理的重要工具。柳樹皮:傳統上用於退燒,後來從中分離出水楊酸,成為阿司匹靈的基礎——這是最廣泛使用的抗炎和止痛藥之一。青蒿(Artemisia,甜艾草):在中國醫學中被用於治療發燒,後來提供了強效抗瘧藥物青蒿素。
這些例子說明了天然產物如何成為藥物發現的起點,而這一趨勢至今仍在持續。然而,現代的藥物開發方式已經大大進化,呈現出更加複雜的科學、法規和技術框架。
現代藥物發現的框架
現代藥物發現的框架是一個結構化、目標導向且跨學科的過程,其目的是將最初的科學研究轉化為具有商業價值的藥物。與傳統依賴運氣或簡單試錯的方法不同,現代藥物發現基於對分子途徑、疾病機制和目標治療設計的深入理解。
從基礎科學到藥物治療
藥物發現的過程始於對疾病相關分子途徑的科學研究。研究人員會找出疾病的靶點——一個對疾病病理至關重要的蛋白質、基因或細胞機制。通過理解這些靶點如何運作,他們可以有針對性地尋找能與靶點相互作用的治療劑,藉此改變或抑制其功能以產生有益效果。這些治療劑可以是小分子、生物製劑(如抗體)甚至是具有生物活性的天然產物。
藥物發現的跨學科性
這個過程極具跨學科特性,需要以下專家的貢獻:
生物學家和化學家:理解疾病機制並設計具有預期特性的分子。工程師與生物資訊學專家:優化配送系統和預測藥物行為的計算模型。計算生物學家:利用生物資訊工具分析複雜的生物數據,選擇有潛力的靶點並研究分子間的相互作用。商業與法務專家:確保過程符合法規標準並具有商業價值,處理知識產權(IP)與市場策略。
現代藥物發現的協作特性需要數以千計的人員參與,並可能為單一藥物耗資超過10億美元。這種高成本部分源於像美國食品藥品監督管理局(FDA)等法規機構制定的嚴格標準,這些標準要求提供藥物有效性與安全性的證據。雖然這些標準保護患者安全,但同時大幅增加了開發過程的時間、複雜性及成本。
商業模式在藥物開發中的角色
製藥公司之所以願意投入藥物開發,是因為專利藥物的高利潤。然而,這種激勵旨在推動創新,但有時可能與治療需求相衝突。理想情況下,治療需求與市場激勵是一致的;然而,特別是在商業模式無法支持低市場吸引力領域的開發時,這種一致性並非總是存在。
例如,抗生素的開發便是一個獨特的案例。隨著抗生素耐藥性的增加,對新型抗生素的需求也愈發迫切,但開發它們的商業激勵卻非常薄弱。如果一家製藥公司開發了一種新抗生素,可以有效對抗耐藥細菌,最佳的使用策略可能是限制其在醫院或是社區的使用,以保持其效力並減少耐藥性的產生。然而,有限的使用會降低銷售量,使這種產品的利潤遠低於需要定期、長期使用的藥物。結果,儘管抗生素對全球健康至關重要,但過去幾十年裡新抗生素的投資卻很少。
調整商業與治療需求的新模式
針對像抗生素這樣的案例,商業模式與公共衛生需求之間的不匹配促使研究人員和政策制定者探索替代模式,包括:
政府資金和補貼:用於分攤開發成本並鼓勵對低市場回報領域的研究。訂閱模式:醫療系統支付固定金額以獲取抗生素,而不取決於其實際使用頻率,這樣可以讓公司有動機投資抗生素開發。專利延長與市場專有權(exclusivity):提供更長的專有權,以增加投資回報的可能性。
現代藥物發現框架因此不僅是一個科學和技術的工程,也是一個法規和經濟的挑戰。
藥物的類型
在現代醫學中,藥物可以大致分為小分子藥物和生物製劑兩大類,每種類型都有獨特的特性、製造需求和法規途徑。除此之外,還有一些創新的藥物類別,例如活性生物治療劑與細胞療法,這些類別代表了治療開發的新前沿。
小分子藥物
小分子藥物是低分子量化合物(通常小於900 daltons),一般通過化學合成製備。這些藥物常從天然來源中提取的化合物進行優化,其分子小的特性使它們可以穿透細胞膜,有效針對細胞內的蛋白質目標。
合成方式:通常為化學合成,初期可能基於天然產物的結構改造。給藥方式:多為口服,但有時會使用局部塗抹或注射方式。 例子:阿司匹靈(aspirin)、二甲雙胍(metformin)及他汀類藥物(statins)。 生物製劑- 優點:口服、製備與分配簡易、製造成本較低。
生物製劑
生物製劑是一類由生物來源衍生的藥物,通常包括較大的分子結構,如蛋白質、抗體和其他細胞產品。與小分子藥物不同,生物製劑通常需要注射或靜脈輸液方式給藥,因為其複雜結構會在消化系統中分解。
例子:乳癌治療藥物Herceptin和糖尿病用胰島素。
- 優點:高度專一性,off target 毒性較小。
活性生物治療劑
活性生物治療劑是使用活微生物(如益生菌)作為治療劑,旨在利用有益菌調節健康。例如,某些健康個體腸道中的特定細菌可能在某些疾病患者中缺乏,恢復這些細菌可能具有治療效果。
- 優點:毒性小、效果持久(如果細菌建立了穩定的菌落)。
細胞療法
細胞療法使用活細胞(通常是患者或捐贈者的細胞)來治療疾病,例如CAR-T細胞療法用於癌症治療,幹細胞療法則用於組織再生。
藥物動力學(Pharmacokinetics, PK):人體如何處理藥物
藥物動力學是藥物開發中的核心概念,研究藥物進入人體後的作用過程。相對地,藥效學(Pharmacodynamics, PD)則專注於藥物對人體的作用。藥物動力學對於劑量設計、給藥方式、生物利用度和潛在副作用的評估非常重要。PK研究主要涉及四個階段:吸收、分布、代謝和排泄(縮寫:ADME)。
吸收(Absorption)
吸收是藥物進入血液或作用部位的過程。影響吸收的因素包括:
給藥途徑:例如口服、靜脈注射或吸入。某些途徑能更快或更直接地實現吸收。藥物的化學特性:如親水性(溶於水)或疏水性(溶於脂肪)。環境條件:例如吸收部位的血流量與pH值,這些因素會增強或抑制藥物穿越細胞膜的能力。
藥物的吸收效率決定了其生物利用度(bioavailability),即進入系統循環且以活性形式存在的藥物比例。
分布 (Distribution)
分布是指藥物從血液移動到身體不同組織的過程。關鍵考量包括:
血流量:高血流量的器官(如心臟和肝臟)通常更快接收藥物。蛋白質結合:藥物可能與血液中的血漿蛋白結合,從而限制了可自由發揮療效的藥物量。跨越選擇性屏障的能力:例如血腦屏障(BBB)。
分布的一個關鍵指標是分布容積(Vd),它反映了藥物在身體中相對於血液中濃度的分散程度。
血腦屏障是分隔血液與大腦細胞外液的選擇性半透屏障。這一緊密結合的內皮細胞結構只允許特定分子通過,從而保護大腦免受潛在有害物質的侵害。然而,對於治療中樞神經系統疾病的藥物,血腦屏障會帶來挑戰:
大分子或親水性分子難以穿透血腦屏障。 解決策略:
- 設計具有更高血腦屏障穿透性的藥物。
- 使用奈米粒子傳輸系統幫助藥物穿越屏障。
鼻腔給藥:通過鼻腔直接進入神經通路繞過血腦屏障,但是如果想要藥物在腦中有較高的劑量,這種方式效果較差。
代謝 (Metabolism)
代謝將藥物轉化為更易於排泄的水溶性形式,主要在肝臟中進行,分為兩個階段:
修飾(Phase I):包括酶(如細胞色素P450家族)的氧化或還原作用,使藥物變得更具反應性。結合(Phase II):增加極性基團(如葡萄糖醛酸化),提升藥物的溶解性,便於排泄。 代謝可能活化藥物、將其轉化為不活躍的代謝產物,或者在某些情況下產生有毒的中間產物。例如,對乙醯氨基酚(acetaminophen)在高劑量下會生成一種有毒中間產物,可能導致肝損傷。
排泄 (Excretion)
排泄是將藥物及其代謝物從體內移除的過程。常見途徑包括:
腎臟(尿液):最常見的排泄方式,處理水溶性代謝物。肝臟(膽汁):某些代謝物通過膽汁分泌,最終經糞便排泄。其他途徑:如汗液、呼吸和母乳,但這些途徑的貢獻較小。 排泄的效率影響藥物的半衰期(half-life),這對於確定給藥頻率以維持治療濃度且不引起毒性非常重要 (圖一)。
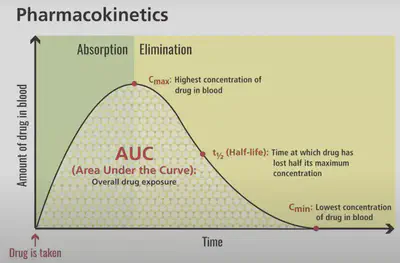
Modelling of PK
有兩種方式:
One component model:假設人體是一個單一的均勻區室,藥物在進入人體後立即均勻分布整個區室,並隨時間經由代謝或排泄而逐漸被清除。Two component model:描述藥物在體內分佈(Distribution phase)與排除(Elimination phase)的過程,分成中央區室與周邊區室,比單一區室的模型更為準確。
藥效學(Pharmacodynamics, PD):藥物對人體的作用
藥效學研究藥物如何與受體、酶或其他細胞靶點作用以產生生物學反應,重點包括藥物作用機制、劑量-反應關係以及治療效果與毒性效應的區分。深入了解藥效學有助於設計療效最大化、副作用最小化的藥物。
藥物與受體的相互作用
大多數小分子藥物通過與特定受體(通常是細胞信號通路或酶作用相關的蛋白質)結合來發揮作用。主要的交互方式包括:
活化劑(Agonists):活化目標受體以產生生物反應。拮抗劑(Antagonists):與受體結合但阻止其活化,有效抑制反應。部分活化劑(Partial Agonists):與受體結合並活化受體,但反應較全活化劑弱。
親和力與效價
親和力(Affinity):描述藥物與受體的結合強度。高親和力的藥物更容易結合,且效果更持久。效價(Potency):通常用半最大有效濃度(EC50)衡量,即藥物達到50%最大效果所需的濃度。- 劑量-反應關係
劑量-反應曲線顯示藥物劑量與生物效應的關係。關鍵指標包括:
最大效應(Emax):藥物能產生的最大效果,無關劑量。藥效(Efficacy):藥物能達到的藥效,在合理劑量內。治療窗(Therapeutic Window):能夠產生治療效果而不引起毒性的劑量範圍。
藥物毒理學(Toxicology):評估藥物的安全性與副作用
毒理學是研究藥物潛在不良反應的學科,在藥物被批准使用之前,確保其安全性是非常重要的。這一領域評估藥物在各種系統與情境下中毒的風險,確保藥物在達成治療目標的同時,不會對健康造成不可接受的影響。
毒理學研究涵蓋藥物安全性的多個面向,包括:
急性毒性:觀察藥物給藥後的即時反應,幫助識別早期副作用或毒性反應。DNA損傷:測試藥物是否會導致基因毒性效應,如突變或致癌風險。生殖健康:評估藥物對生育能力、胎兒發育及後代健康的影響,這對於針對育齡人群的藥物尤為重要。致癌性:研究長期暴露於藥物是否會增加癌症風險。這類研究通常耗時且成本高,需進行長期觀察。
此外,還會針對特定器官進行毒性研究,例如中樞神經系統、呼吸系統和心血管系統。這些研究通常在動物模型中進行,以確保在人類試驗之前,不會出現嚴重器官損害。
治療指數(Therapeutic Index, TI)與其重要性
治療指數(TI)是衡量藥物安全性的重要指標,反映藥物的有效劑量與毒性劑量之間的差距:
高TI:顯示有效劑量與毒性劑量之間有較大空間,使用起來更安全。低TI:表示有效劑量與毒性劑量相距較近,用藥時需要更加謹慎。
例如,抗凝血藥物華法林(warfarin)具有窄治療指數(narrow TI)。劑量過低無法有效防止血栓,劑量過高則可能導致危險的出血。此外,腸道菌群對華法林的代謝因人而異,進一步增加了劑量調整的挑戰。
藥物交互作用
藥物可能通過以下方式相互作用,增強或減弱其作用:
協同作用(Synergistic Interactions):兩種藥物的聯合作用超過單獨使用的總和。例如,酒精與鎮靜劑都會抑制中樞神經系統,聯合使用可能導致危險的過度鎮靜效應。拮抗作用(Antagonistic Interactions):一種藥物可能阻斷或抵消另一種藥物的作用。例如,納洛酮(naloxone)通過與鴉片受體結合阻止鴉片類藥物的作用,因此被用作鴉片過量的解毒劑。加和效應(Additive Effects):某些藥物的聯合作用僅是其單獨作用的總和。例如,降壓藥聯合使用可能更有效地降低血壓,但需謹慎避免過度降壓。
藥物開發的步驟
藥物開發是一個高度結構化、多階段的過程,從針對疾病的初步構想到可上市的藥物,期間經歷了大量科學驗證、候選化合物的優化及安全性和有效性的廣泛測試。以下是這一過程的主要階段:
靶點識別(Target Identification)
第一步是識別一個靶點——通常是一個與疾病機制密切相關的蛋白質或基因。靶點選擇基於生物資訊學、基因組學和蛋白質組學,並常使用高通量篩選技術或生物資訊工具。關鍵考量包括:
與疾病的關聯性:該靶點在疾病中有多重要?可藥性(Druggability):小分子或生物製劑是否能有效地與該靶點結合?結構可用性:是否存在靶點的結構數據或預測(如使用AlphaFold)來指導分子結合設計?
靶點通常包括酶、受體或疾病機制中關鍵的信號蛋白。然而,一些靶點可能具有挑戰性,例如無穩定結合位點的無序蛋白或大的平面結構的轉錄因子。這種情況下,可以考慮生物製劑(單株抗體)或是基因治療(利用CRISPR)。
靶點驗證(Target Validation)
在靶點識別之後,靶點驗證旨在確認其在疾病中真的具有療效。常見的驗證技術包括:
CRISPR篩選與基因過表達研究:操控基因活性並觀察結果。動物模型:模擬疾病狀態。生物標誌物分析:在人類樣本中驗證疾病相關性,提供早期治療效果的線索。
靶點驗證對於確認調節該靶點是否能帶來治療效果非常重要,避免將無效或無關的靶點列為研究對象。
命中化合物識別(Hit Identification)
在確認靶點後,下一步是識別與靶點相互作用的潛在化合物(hits)。方法包括:
高通量篩選(HTS):使用生化或細胞篩選方法對大量化學庫進行篩選以找到初步活性化合物。片段篩選:使用較小的化學片段 (fragment-based)結合靶點,然後擴展為更有效的化合物。虛擬篩選:使用計算方法基於靶點結構預測化合物的結合能力,利用分子對接與機器學習技術。
命中化合物識別是一個篩選過程,通常從數百萬個化合物中選出少量具有良好結合特性的化合物。
命中到先導優化(Hit-to-Lead Optimization)
選定命中化合物後,進一步優化其結構並研究結構活性關係(structure-activity relationship, SAR),以提升結合親和力、特異性和藥物動力學特性:
對化學結構進行迭代修改,提升療效、減少脫靶效應,並改進穩定性和溶解度。一些方式包含:fuctional group modification、chain length alteration、ring modification、isosteric replacement、QSAR等。- 初步進行藥物動力學評估(如吸收、分布、代謝、排泄)。
這一步驟旨在將具有潛力的命中化合物轉化為先導化合物,為後續深入研究做好準備。
先導化合物優化(Lead Optimization)
在這一階段,對先導化合物進行深入的化學與生物物理研究,進一步優化:
提升結合親和力:提高藥效。減少脫靶效應:降低毒性風險。優化藥物動力學特性:改進半衰期與生物利用度。在疾病模型中的療效:確保早期測試中的療效在更複雜的模型中同樣適用。
最終選出的候選化合物將平衡治療效力與安全性,為臨床前與臨床研究鋪平道路。
藥物開發的時間線
藥物開發時間線漫長且嚴格,反映出高標準要求以確保療效與安全性。從初始的藥物發現到獲批上市,這一過程通常耗時數十年,涵蓋多個階段,每個階段都面臨顯著挑戰與法規的監督。
藥物發現階段
這一階段可能耗時數年甚至數十年,包括靶點識別、命中化合物發現及先導化合物的早期優化。 許多初始候選化合物因缺乏療效或安全性問題而被淘汰,只有少數進入下一階段。
臨床前測試
一旦確定了有潛力的先導化合物,便進行臨床前測試,主要在細胞培養和動物模型中進行。 這一階段評估藥物的基礎療效、毒性、藥物動力學和藥效學。 研究結果用於支持提交給FDA的新藥臨床試驗申請(IND)。
IND申請
提交IND申請是臨床試驗開始前的關鍵步驟。該申請包含安全性數據、製造信息以及擬定的臨床試驗計劃。 如果FDA在指定時間內無異議,藥物開發方即可進行I期臨床試驗。
臨床試驗階段
臨床試驗分為三個主要階段,每個階段回答關於藥物的特定問題:
I期:安全性與劑量~在20-80名健康志願者或患者中進行,主要評估安全性並確定適當的劑量範圍。目標是建立初步的PK/PD特性,並找出潛在副作用。II期:療效與副作用~包括數十到數百名患有目標疾病的患者。著重於劑量方案的優化,並檢測早期療效。該階段為決定是否進一步投入昂貴的III期試驗提供關鍵數據。III期:大規模測試~涉及數百到數千名患者,提供獲得法規批准所需的全面數據。該階段確認療效,監測副作用,並收集患者群體的綜合安全數據。- 上市後監測(IV期)~獲批後的IV期研究或上市後監測,持續觀察藥物在普通人群中的表現。此階段評估長期安全性,可能揭示在臨床試驗中未觀察到的罕見副作用。
成功率與淘汰率
整個過程中藥物的淘汰率極高,進入臨床試驗的藥物中僅約14%得以批准上市。例如,癌症藥物的成功率更低,從I期至上市的成功率僅約3%(圖二)。
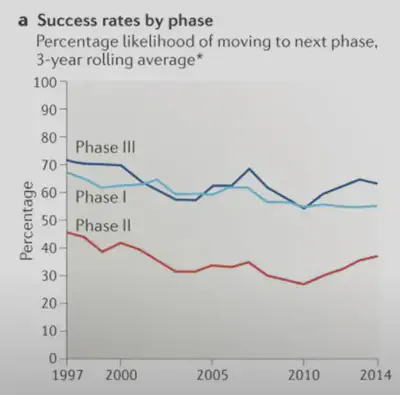
財務影響
藥物開發成本極高,單一藥物平均耗資約10億美元。成本涵蓋了成功藥物與失敗試驗的總和,FDA批准過程本身也涉及高昂的行業費用,例如IND和新藥申請(NDA)的提交費用。
結論
藥物開發是一個複雜、多階段的過程,需耗費大量時間、資源與法規合規性。這一漫長的時間線和高淘汰率凸顯了開發安全有效藥物的困難與昂貴,強調了精準與創新的重要性。未來,我們將進一步探索現代計算技術如何縮短藥物開發時間線,提高成功率並降低總成本。